Nutrizione in oncologia: primum non nocere
 L’intervento nutrizionale nelle persone affette da patologia oncologica implica un approccio dinamico all’alimentazione, per consentirne l’adattamento alle varie fasi della malattia, finalizzato ad ottimizzare la risposta immunitaria dell’organismo e la qualità della vita, sia nella fase perioperatoria, che durante le terapie, per aumentarne l’efficacia e ridurne gli effetti collaterali, e poi nella convalescenza, intervenendo su quei fattori di rischio che possono concorrere a determinare complicanze e/o recidive, ma anche problematiche nutrizionali.
L’intervento nutrizionale nelle persone affette da patologia oncologica implica un approccio dinamico all’alimentazione, per consentirne l’adattamento alle varie fasi della malattia, finalizzato ad ottimizzare la risposta immunitaria dell’organismo e la qualità della vita, sia nella fase perioperatoria, che durante le terapie, per aumentarne l’efficacia e ridurne gli effetti collaterali, e poi nella convalescenza, intervenendo su quei fattori di rischio che possono concorrere a determinare complicanze e/o recidive, ma anche problematiche nutrizionali.
Indispensabile quindi una valutazione nutrizionale precedente agli interventi terapeutici per attestare l’eventuale presenza di malnutrizione. La malnutrizione in oncologia, intesa come eccesso/difetto proteico-calorico, carenza di micronutrienti, eccesso di grassi saturi e zuccheri raffinati, scarsa varietà quotidiana di cibi, etc., è un problema ricorrente che va individuato precocemente e che è in genere dovuto a vari fattori legati alla patologia stessa o ai trattamenti: alterazioni della percezione del gusto, difficoltà di masticazione e di deglutizione, maldigestione, diarrea, depressione, senza contare la diffusa abitudine, in genere ben precedente alla patologia, ad imbandire la tavola seguendo consigli pubblicitari, packaging accattivanti oppure prodotti di moda, piuttosto che privilegiare gli aspetti nutrizionali del mangiare.
Ciò non vuol certo significare la rinuncia al gusto, al piacere della tavola, alla convivialità dei pasti, tutti aspetti estremamente importanti da curare con attenzione, ma piuttosto significa cercare di ricavare spazi da dedicare alla preparazione delle pietanze, anche avvalendosi di ricette, per trasformare il momento dei pasti in momenti da dedicare a se stessi, al relax, alla creatività, guardando al cibo come una chance da sfruttare per acquisire benessere.
La valutazione nutrizionale è da ripetersi in itinere per modificare adeguatamente l’approccio nutrizionale, insieme ad analisi del sangue che includano parametri ematici atti ad individuare carenze, anche subcliniche, che rappresentano, nell’individuo affetto da patologia oncologica, un segno prognostico negativo.
Ciò ha infatti un impatto significativo sull'immunocompetenza umorale e cellulare, sulle funzioni tessutali e riparative, potendo anche aumentare la severità degli effetti collaterali a causa della minore capacità dell’organismo di tollerare/sostenere il trattamento chemioterapico o radioterapico. In ogni fase del percorso terapeutico, quindi, l’intervento nutrizionale deve essere monitorato a intervalli regolari per valutare miglioramenti, difficoltà, compliance del paziente, interferenze nel percorso nutrizionale causate da effetti collaterali legati ai farmaci e andamento dello stato nutrizionale per avere la possibilità di variare la prescrizione dietetica in rapporto alla risposta al trattamento.
Attuare una scelta dietetica
In letteratura scientifica, vi sono numerosi approcci nutrizionali in oncologia, dalla dieta fondata su tradizioni mediterranee a quella, di acquisizione più recente, definita plant-based, dalle quali emerge la loro efficacia nel regolarizzare i livelli di insulina e glicemia, migliorare il profilo lipidico e i valori pressori, favorendo il controllo del peso e migliorando il generale stato di benessere.
Viceversa, studi epidemiologici hanno dimostrato un aumento del rischio di tumore, in particolare mammario e intestinale, in relazione ad alimentazione tipicamente occidentale, sovrappeso, vita sedentaria, alti livelli sierici di ormoni sessuali, oltre ad insulina e IGF-?1.
Tali evidenze suggeriscono quindi di attuare un cambiamento di stile di vita, favorendo l’attività fisica, costante e adeguata alla situazione personale, e orientando le scelte dietetiche verso alimenti selezionati secondo una priorità assoluta: non alimentare la patologia a tavola.
Spesso invece ci si focalizza sui cibi che risultano più graditi, oppure su quelli che possano aiutare ad affrontare piccoli problemi quotidiani, quali diarrea, stipsi, difficoltà digestive, oppure complicanze quali anemia ed osteopenia, tralasciando, anche involontariamente, la suddetta priorità. È il caso di alimenti come il riso, specie non integrale, di certo tradizionalmente indicato in casi di alvo alterato, ma che rispetto a qualsiasi altro cereale o pseudocereale ha la quantità di carboidrati più elevata, risultando quindi un alimento ad elevato indice glicemico. Ciò, pur aiutando ad alleviare la problematica intestinale, risulta controindicato in molte patologie oncologiche per le quali elevata biodisponibiltà di zuccheri e concomitante basso apporto di fibre, in quanto le verdure e l’”integrale” sono spesso evitati in caso di diarrea, costituiscono un binomio inadeguato in oncologia.
Analogamente, ricorrere a prodotti lattocaseari per l’apporto di calcio porta con sé una serie di conseguenze non raccomandate in oncologia, quali favorire modifiche negative di pH tissutale, predisponenti all’infiammazione e a diverse tipologie di tumore quali quello mammario, indurre sia iperinsulinemia postprandiale che aumentati livelli sierici di IGF-?1.
E la lista di cibi che divergono, per motivi anche molto diversi tra loro, dalla suddetta priorità è ancora lunga.
Come procedere quindi? Quali criteri di selezione adottare affinché si rispetti la priorità imprescindibile di non nutrire il tumore?
Dal principio guida alla tavola imbandita
Partendo dal concetto che non esistono alimenti indispensabili, in quanto il corpo necessita di nutrienti essenziali che possono esser ricavati da alimenti diversi, occorre selezionare i cibi che consentano di ottemperare al nostro obiettivo, basandosi sul principio guida “minor rischio/maggior beneficio”.
In sostanza, oltre al target nutrizionale che si vuole raggiungere con il cibo scelto, occorre preoccuparsi anche di quali possano essere le conseguenze indesiderate, come appena riportato nell’esempio dei prodotti lattocaseari.
In effetti, aiuta molto una visione d’insieme, per la quale, rimanendo sull’esempio “calcio-? osteopenia”, non si può non considerare che il metabolismo osseo è influenzato da molteplici fattori e per contrastare/prevenire l’osteopenia, ad esempio conseguente alla chemioterapia, non basta preoccuparsi dell’apporto di calcio, ma occorre occuparsi anche di tutti gli altri fattori che sono con esso interconnessi: oltre a scegliere alimenti alcalinizzanti, piuttosto che acidificanti, è opportuno preoccuparsi della qualità e quantità delle proteine inserite nella dieta, nonché assicurare buoni livelli di magnesio, potassio, vitamina K e vitamina D e contemporaneamente limitare gli apporti di fosforo e sodio (di cui molti formaggi sono ricchi) e mantenere un’attività fisica sotto carico, adeguata alla propria condizione fisica.
Si raccomanda quindi di prediligere alimenti di stagione, freschi, integrali, a basso indice glicemico, ricchi di fibre, proteine vegetali e micronutrienti, poveri di grassi saturi, sodio e privi di grassi idrogenati, a minor carico possibile di inquinanti, additivi, conservanti e coloranti, ormoni, pesticidi, metalli pesanti, ovvero interferenti endocrini. In particolare, la nutrizione in oncologia si gioverà di tutti quei cibi naturalmente capaci di svolgere un ruolo preventivo e protettivo, oltre che nutrizionale, consentendo di attenersi alla priorità data, in base al principio guida rischio/beneficio, ovvero apportando nutrienti senza creare condizioni favorenti la patologia oppure problematiche di salute o carenziali.
Tali cibi sono prevalentemente quelli ricchi di fitochimici, sostanze contenute solo ed esclusivamente nei prodotti vegetali, classificati in tre gruppi, polifenoli, carotenoidi e glucosinolati, categorie all’interno delle quali troviamo molecole ormai note anche al grande pubblico, come antociani, lignani, flavonoidi, ma anche licopene, resveratrolo, curcumina, sulforafano, etc.
FITOCHIMICI NEGLI ALIMENTI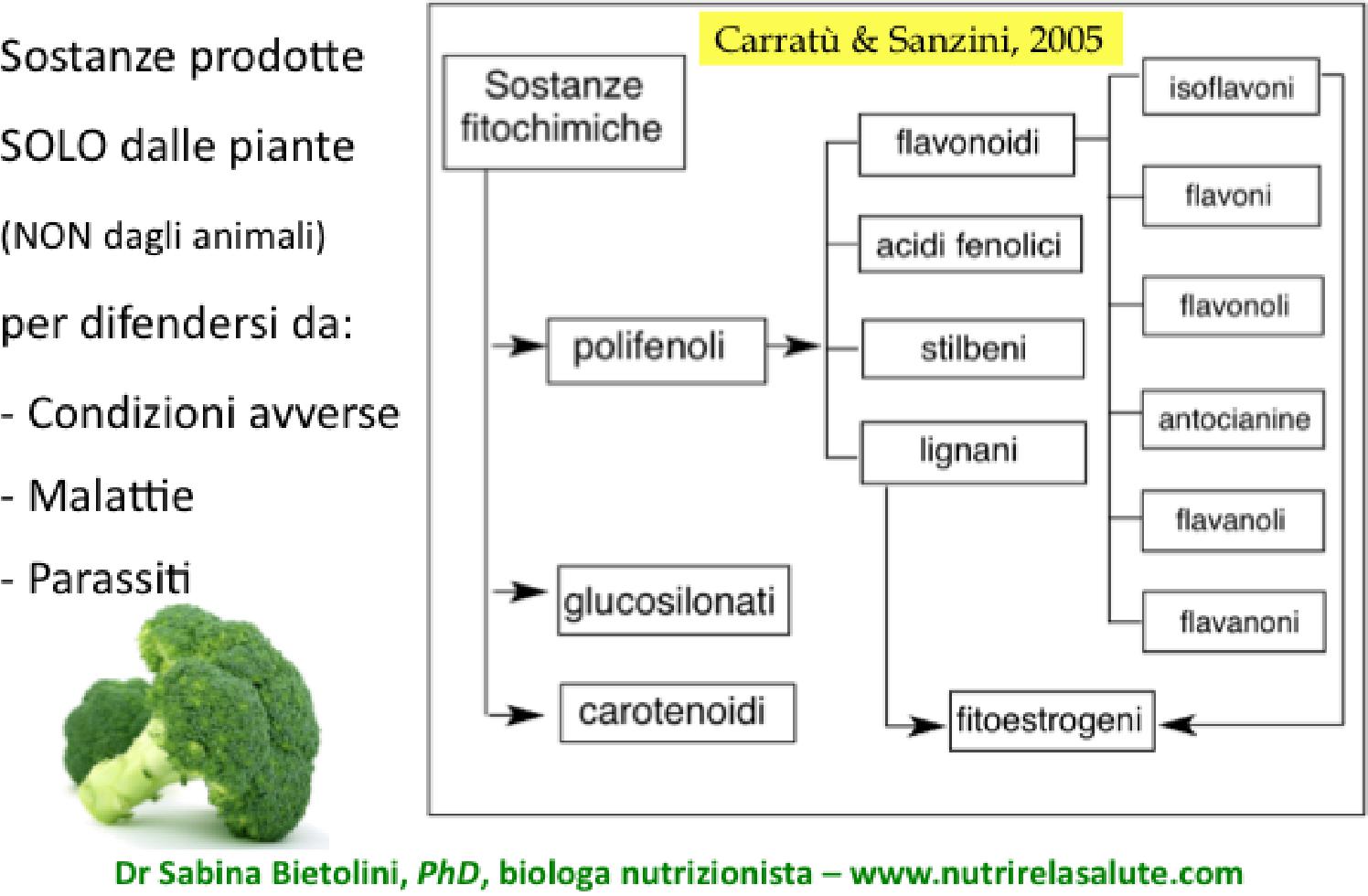
Tali sostanze, da circa vent’anni, sono protagoniste della branca della ricerca scientifica a nome nutrigenomica, dalla quale emergono numerose e continue conferme circa i benefici che i fitochimici forniscono al nostro organismo, attraverso molteplici attività, tra cui: modulare positivamente l’espressione genica di molecole antiossidanti e detossificanti, intervenire nella replicazione cellulare e nell’apoptosi, nonché a sfavore di processi infiammatori, angiogenesi e progressione tumorale, proteggere la mucosa intestinale e svolgere un riequilibrio qualitativo e quantitativo del microbiota, favorendo l’eubiosi.
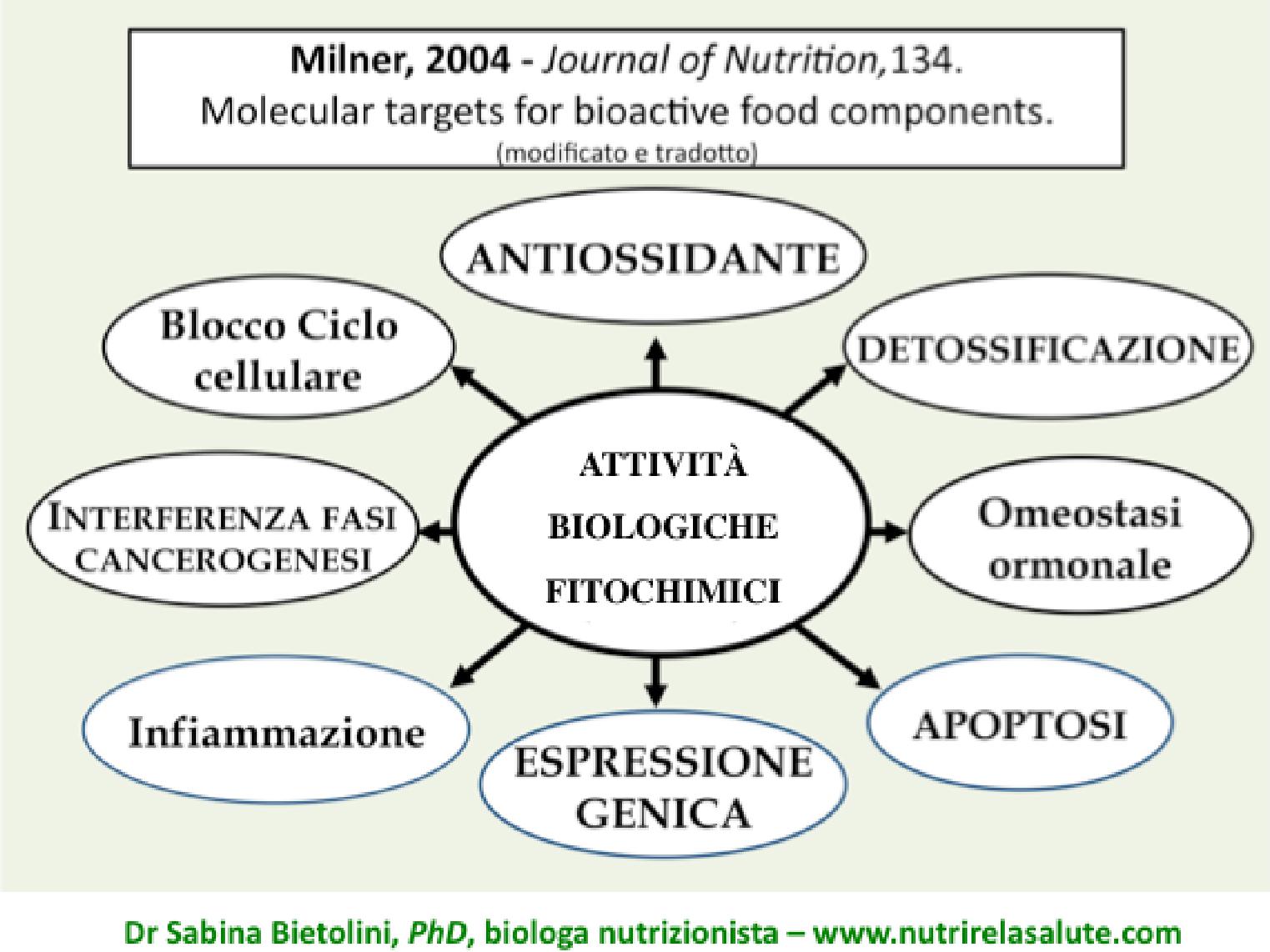
Quest’ultima azione è svolta con successo anche da un adeguato apporto dietetico di fibre, anch’esse esclusivamente presenti nei cibi vegetali, ragione ulteriore per indulgere su una scelta dietetica definibile plant-based. Peraltro, le fibre, tra le molteplici attività svolte nel nostro intestino, sono in grado di nutrire quei componenti del microbiota capaci di produrre acidi grassi a catena corta, che esercitano azioni dirette ed indirette di protezione della mucosa intestinale, prevenendo il fenomeno della permeabilità intestinale, e quindi reazioni infiammatorie in tale sede, nonché di sostegno del sistema immunitario, sia localmente (intestino) che a livello sistemico. Questa affermazione trova la sua ragion d’essere nell’anatomia del sistema immunitario, che nel corpo umano adulto mostra una concentrazione a livello intestinale pari a circa il 60-?70%, in un tessuto linfoide associato all’intestino, definito in acronimo GALT.
ALCUNE AZIONI SVOLTE DALLE FIBRE NEL TRATTO GASTROINTESTINALE UMANO

Nutrizione come strumento di difesa e non di offesa
In considerazione del fatto che la nutrizione è uno degli strumenti di prevenzione e protezione più potenti che il nostro organismo abbia a disposizione, occorre assicurarsi che qualsivoglia piano nutrizionale venga proposto, sia in grado di rendere attivo ed efficace tale strumento, anche in relazione alla fase della patologia ed ai più frequenti effetti collaterali associati ad eventuali trattamenti radio-?chemioterapici (irritazione intestinale e delle mucose in generale, diarrea, nausea e vomito, alterazione del gusto, difficoltà digestive, perdita di energia, acidificazione tissutale, intossicazione iatrogena, etc), oppure al perioperatorio.
Importante quindi fornire nutrienti in linea con le raccomandazioni dei LARN 2014, mirando a ridurre le difficoltà digestive, di buona biodisponibilità, sfruttando le naturali sinergie tra alimenti, evitando cibi che possano interferire con il trattamento farmacologico e/o che inducano sollecitazioni intestinali infiammatorie e/o immunostressogene, squilibri metabolici ed ormonali, nonché sovraccarico renale e/o epatico.
In tal senso, il consumo di prodotti animali, incluso il pesce, va ridotto, possibilmente evitato, per la presenza di inquinanti noti come interferenti endocrini, ovvero fitofarmaci provenienti dai mangimi, oppure, in ambito ittico, identificabili con metalli pesanti e diossina.
A questo aspetto, occorre sommare la ormai nota capacità delle proteine di origine animale di alterare la composizione del microbiota, a sfavore delle specie che producono i summenzionati acidi grassi a catena corta, privando quindi l’organismo di tutti i benefici che derivano da tali grassi, in un momento in cui è quanto mai necessario perseguire l’eubiosi, anziché contrastarla, per ottenere una miglior risposta immunitaria. In questo frangente, quindi, oltre al principio guida occorre avvalersi del principio di precauzione, a cui è indispensabile far riferimento in quanto un organismo affetto da patologia tumorale è già sottoposto ad un carico importante, spesso purtroppo complicato da farmaci, radioterapia, operazioni chirurgiche, nonché metastasi oppure recidive in tempi ravvicinati, ed è buona norma sfruttare la dieta per sostenere il corpo, depurarlo e rinforzarne i meccanismi di difesa, anziché sottoporlo a ulteriori challenge per fornire nutrienti (principio guida “rischio/beneficio”).
La preoccupazione di non fornire omega 3 può essere risolta, sia inserendo alimenti di origine vegetale quali alghe a basso contenuto di iodio, lino, chia, noci e canapa, oppure ricorrendo ad integratori di omega 3 algale, al fine di non rinunciare all’importante contributo antinfiammatorio e di regolazione della fluidità della membrana cellulare assolto da tali grassi.
Utile infine ricordare che affinché sia consentita la ripresa di un’efficace e pronta risposta immunitaria, è opportuno che la dieta sia in grado di fornire i cosiddetti immunonutrienti, ovvero quei nutrienti che direttamente o indirettamente possono modulare la risposta immunitaria ed infiammatoria, tra i quali si annoverano: glutammina e arginina, omega 3 e omega 9, selenio, ferro, magnesio, zinco, rame, vitamine A, B, C, D, E.
Per tutti quei nutrienti per i quali si riscontrino carenze, oppure i cibi scelti non siano in grado di coprire con certezza il fabbisogno giornaliero, è opportuno ricorrere ad integrazioni, in linea con i LARN 2014, al fine di evitare sovraddosaggi, privilegiando comunque sempre la dieta per coprire i fabbisogni, specie di vitamine del complesso B, il cui ruolo nelle patologie oncologiche può risultare controverso, qualora vengano assunte da integratori, piuttosto che attraverso il cibo.
Alimenti con immunonutrienti
TARGET DELL’INTERVENTO NUTRIZIONALE IN ONCOLOGIA (approccio dr S. Bietolini)
| Prevenire perdita di peso durante il periodo peri chemio-radiologico/operatorio | Aumentare la tolleranza al trattamento farmaco/chemio/radiologico ed ottimizzare la risposta ad esso |
| Preservare/aumentare la massa magra (muscoli) Ridurre la massa grassa, se in eccesso Ridurre il grasso viscerale |
Potenziare la risposta immunitaria, attraverso un attento apporto di immunonutrienti, fibre, fitochimici e quantità ridotta/nulla di cibi proinfiammatori |
| Controllare/regolare alcuni parametri ematici di particolare rilevanza per la patologia in questione | Migliorare la qualità di vita, anche in termini di effetti collaterali sia qualitativamente che quantitativamente |
| Eventuale recupero del peso forma | Riequilibrare il microbiota e favorire la produzione di acidi grassi a catena corta |
| Risolvere/prevenire eventuali deficit nutrizionali | Recupero/mantenimento della regolarità intestinale |
| Fornire una adeguata idratazione | Evitare sovraccarichi di organo |
BIBLIOGRAFIA
Bolori et al. 2019. Adherence to a healthy plant diet may reduce inflammatory factors in obese and overweight women(...). Diabetes & Metabolic Syndrome: Clin Res, Jul-Aug 2019;13(4):2795-2802.
Cade et al. 2010. Common dietary patterns and risk of breast cancer: analysis from the United Kingdom Women’s Cohort Study. Nutr Cancer, 62: 300-306.
Calder, 2010. Omega-3 fatty acids and inflammatory processes. Nutrients, Mar;2(3):355-74.
Carratù & Sanzini, 2005. Sostanze biologicamente attive presenti negli alimenti di origine vegetale. Ann Ist Super Sanità, 41(1): 7-16.
Castro-Quezada et al. 2014. The Mediterranean Diet and Nutritional Adequacy: A Review. Nutrients, 6: 231-248. Craddock, 2016. Does supplementation with non-animal forms of dha improve dha omega-3 indices in vegetarians and vegans? J Nutrition & Intermediary Metabolism 4,47.
Mehdi Damaghi et al. 2015. Chronic Acidosis in the Tumour Microenvironment Selects for Overexpression of LAMP2 in the Plasma Membrane. Nat Commun. Dec 10;6:8752.
Christopher et al. 2012. Pulse grain consumption and obesity: effects on energy expenditure, substrate oxidation, body composition, fat deposition and satiety. British Journal of Nutrition, Aug;108 Suppl 1:S46-51.
de Lorgeril M. & Salen P. 2014. Helping women to good health: breast cancer, omega-3/omega-6 lipids, and related lifestyle factors. BMC Medicine, 12:54.
Ferrucci et al. 2009. Intake of meat, meat mutagens, and iron and the risk of breast cancer in the Prostate, Lung, Colorectal, and Ovarian Cancer Screening Trial. Br J Cancer, 101: 178-184.
Frenzel et al. 2013. The influence of body composition on quality of life of patients with breast cancer. Nutr Hosp, 28:1475-1482.
Hardman WL 2014. Diet components can suppress inflammation and reduce cancer risk. Nutr Res Practice;8(3). Hargrove et al. 2011. Inhibition of Aromatase and a-Amylase by Flavonoids and Proanthocyanidins from Sorghum bicolor Bran Extracts. J Med Food 14 (7-8): 799–807.
Hassan et al. 2013. Oleuropein induces apoptosis via the p53 pathway in breast cancer cells. Asian Pac J Cancer Prev, 14(11): 6739-42.
Hussain et al. 2013. Sulforaphane Inhibits Growth of Human Breast Cancer Cells and Augments the Therapeutic Index of the Chemotherapeutic Drug, Gemcitabine. Asian Pac J Cancer Prev, 14(10): 5855-5860.
Joseph et al. 2016. Fruit Polyphenols: A Review of Anti-inflammatory Effects in Humans. Crit Rev Food Sci Nutr;56(3). Keibel et al. 2009. Inflammation, Microenvironment, and the Immune System in Cancer Progression. Current Pharmaceutical Design, 15(17):1949-55.
Kushi et al. 2012. American Cancer Society guidelines on nutrition and physical activity for cancer prevention reducing the risk of cancer with healthy food choices and physical activity. CA Cancer J Clin, 62:30–67.
LARN 2014. Livelli di Assunzione di Riferimento di Nutrienti ed Energia; consultabili su www.sinu.it
Lis et al, 2012. Role of nutritional status in predicting quality of life outcomes in cancer-a systematic review of the epidemiological literature. Nutr J. Apr 24;11:27.
Macciò & Madeddu, 2011. Obesity, Inflammation, and Postmenopausal Breast Cancer: Therapeutic Implications. The Scientific World J, 11, 2020–2036.
Marconett et al. 2011. Indole-?3-?carbinol downregulation of telomerase gene expression requires the inhibition of estrogen receptor-?alpha and Sp1 transcription factor interactions within the hTERT promoter and mediates the G1 cell cycle arrest of human breast cancer cells. Carcinogenesis, 32;9:1315–1323.
Mathers JC. 2004. The biological revolution – towards a mechanistic understanding of the impact of diet on cancer risk. Mutation Research, 551: 43–49.
Melnik. 2009. Milk – the promoter of chronic Western diseases. Med Hypoth, Jun;72(6):631-?9.
Mosele et al. 2015. Metabolic and Microbial Modulation of the Large Intestine Ecosystem by Non-Absorbed Diet Phenolic Compounds. Molecules 20, 17429-?17468.
Ouhtit et al. 2013. Simultaneous inhibition of cell-cycle, proliferation, survival, metastatic pathways and induction of apoptosis in breast cancer cells by a phytochemical super-cocktail (....). J of Cancer, (4): 703-?715.
Oyebode et al. 2014. Fruit and vegetable consumption and all-cause, cancer and CVD mortality: analysis of Health Survey for England data. J Epidemiol Community Health. Sep;68(9):856-?62
Perugini et al. 2009. Levels of total mercury in marine organisms from Adriatic Sea, Italy. Bull Environ Contam Toxicol, Aug;83(2):244-?8.
Reuben et al. 2012. Modulation of angiogenesis by dietary phytoconstituents in the prevention and intervention of breast cancer. Mol Nutr Food Res, Jan;56(1): 14-?29.
Rockenbach et al. 2011. Dietary intake and oxidative stress in breast cancer: before and after treatments. Nutr Hosp;26(4):737-?744.
Rowland et al. 2018. Gut microbiota functions: metabolism of nutrients and other food components. Eur J Nutr. Feb;57(1):1-24.
Romaguera et al. 2009. Adherence to the Mediterranean diet is associated with lower abdominal adiposity in European men and women. J Nutr, 139: 1728–1737.
Rose & Strombom, 2018. A plant-?based diet prevents and treats prostate cancer. Canc Ther & Oncol Int J. 11(3). Sanchez-?Lara K. et al. 2013. Gastrointestinal symptoms and weight loss in cancer patients receiving chemotherapy. British Journal of Nutrition, 109, 894–897.
Singh et al. 2017. Influence of diet on the gut microbiome and implications for human health. J Transl Med, 15. Sofi et al. 2013. Mediterranean diet and health. Biofactors, Jul-?Aug;39(4):335-?42.
Taylor et al. 2007. Meat consumption and risk of breast cancer in the UK Women’s Cohort Study. Br J Cancer, 96:1139-?46. Tilghman et al. 2013. Phytoalexins, miRNAs and Breast Cancer: A Review of Phytochemical-mediated miRNA Regulation in Breast Cancer. J Health Care Poor Underserved, February;24: 36–46.
Tomasello et al. 2014. Dismicrobism in inflammatory bowel disease and colorectal cancer: changes in response of colocytes. World J Gastroenterol, Dec 28; 20(48).
Turner-McGrievy et al. 2017. A plant-?based diet for overweight and obesity prevention and treatment. J G C, May;14(5):369-?374.
Veldhoen & Brucklacher-Waldert, 2012. Dietary influences on intestinal immunity. Nature Rev Imm, 12(10). Veldhoen & Ferreira. 2015. Influence of nutrient-derived metabolites on lymphocyte immunity. Nature Med, 21. Vipperla & O’keefe, 2016. Diet, Microbiota, and Dysbiosis: a “recipe” for colonrectal cancer. Food & Function,
Apr;7(4):1731-?40,
Zheng et al. 2017. Dietary patterns and risk of pancreatic cancer: a systematic review. Nutr Rev. 75(11):883–908. WCRF/AICR 2007. Food, nutrition, physical activity, and the prevention of cancer: a global perspective. Washington DC, AICR.
WCRF/AICR 2018. Diet, Nutrition, Physical Activity and Cancer: a Global Perspective. Continuous Update Project Third Expert Report. Available at dietandcancerreport.org
Welch et al, 2008. Urine pH is an indicator of dietary acid-?base load, fruit and vegetables and meat intakes: results from the European Prospective Investigation into Cancer and Nutrition (EPIC)-Norfolk population study, Br J Nutr, 99(6):1335-?43.
Williams & Patel. 2017. Healthy Plant-Based Diet: What Does it Really Mean? J Am Coll Cardiol, Jul 25;70(4):423-?425. Zhu et al. 2018. Anti-inflammatory effects of phytochemicals from fruits, vegetables, and food legumes: A review. Critical Reviews Food Science & Nutrition, May 24;58(8):1260-?1270.

 RSS
RSS